what do SUMO do?
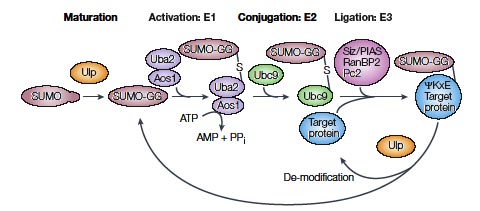
ユビキチン様タンパク質SUMOはその名の通りユビキチンに類似した構造をしており、反応系もユビキチンに似た酵素反応により標的タンパク質に結合し、その制御をしています。SUMOが修飾可能な活性型になるためには、C末端のglycine残基を突出させなければなりません。この働きはプロテアーゼが関与していると考えられています。
SUMOのC末端に存在する二つのglycine残基は結合に重要で、このglycine残基がSUMO活性酵素(E1)のcysteineとチオエステル構造をとることで活性化されます。活性化状態になったSUMOは結合酵素(E2)によって転写され、標的タンパク質中のLysine残基側鎖とイソペプチド結合することで付加修飾反応は完了します。ヒトSUMO-1では97番glycine残基と98番histidine残基間のペプチド結合が切断され、修飾可能な活性型へと転換されます。分裂酵母ではPmt3pのC末端に保存された二つのglycine残基(Gly110-Gly111)に相当します。また、促進因子であるSUMO特異的リガーゼ(E3)と呼ばれる因子を必要とすることがあります。
また、SUMO化蛋白質からSUMOを遊離させる活性の存在が示された報告がある。イソペプチターゼと呼ばれる酵素がこの活性を行い、この酵素の存在が、SUMO化蛋白質の量的変動の調節を行っていると考えられています。遊離されたSUMOが細胞内でどのように再利用叉は分解されるのかはまだはっきりとはわかっていません。
出芽酵母におけるSUMOの修飾経路の模式図
